Pendahuluan
Kata karbohidrat berasal dari kata karbon dan air. Secara sederhana karbohidrat didefinisikan sebagai polimer gula. Karbohidrat adalah senyawa karbon yang mengandung sejumlah besar gugus hidroksil. Karbohidrat paling sederhana bisa berupa aldehid (disebut polihidroksialdehid atau aldosa) atau berupa keton (disebut polihidroksiketon atau ketosa). Berdasarkan pengertian di atas berarti diketahui bahwa karbohidrat terdiri atas atom C, H dan O. Adapun rumus umum dari karbohidrat adalah:
Cn(H2O)n atau CnH2nOn
Fungsi karbohidrat
Fungsi primer dari karbohidrat adalah sebagai cadangan energi jangka pendek (gula merupakan sumber energi). Fungsi sekunder dari karbohidrat adalah sebagai cadangan energi jangka menengah (pati untuk tumbuhan dan glikogen untuk hewan dan manusia). Fungsi lainnya adalah sebagai komponen struktural sel.
Klasifikasi karbohidrat
Karbohidrat dapat dikelompokkan menurut jumlah unit gula, ukuran dari rantai karbon, lokasi gugus karbonil (-C=O), serta stereokimia.
Berdasarkan jumlah unit gula dalam rantai, karbohidrat digolongkan menjadi 4 golongan utama yaitu:
1. Monosakarida (terdiri atas 1 unit gula)
2. Disakarida (terdiri atas 2 unit gula)
3. Oligosakarida (terdiri atas 3-10 unit gula)
4. Polisakarida (terdiri atas lebih dari 10 unit gula)
Pembentukan rantai karbohidrat menggunakan ikatan glikosida.
Berdasarkan lokasi gugus –C=O, monosakarida digolongkan menjadi 2 yaitu:
1. Aldosa (berupa aldehid)
2. Ketosa (berupa keton)

Klasifikasi karbohidrat menurut lokasi gugus karbonil
Berdasarkan jumlah atom C pada rantai, monosakarida digolongkan menjadi:
1. Triosa (tersusun atas 3 atom C)
2. Tetrosa (tersusun atas 4 atom C)
3. Pentosa (tersusun atas 5 atom C)
4. Heksosa (tersusun atas 6 atom C)
5. Heptosa (tersusun atas 7 atom C)
6. Oktosa (tersusun atas 3 atom C)

Klasifikasi karbohidrat menurut jumlah atom C

Contoh monosakarida
Contoh pertama di atas (sebelah kiri) menunjukkan sebuah monosakarida triosa (memiliki 3 atom C), aldosa (berstruktur aldehid/-COH) sehingga dinamakan gula aldotriosa. Sedangkan contoh kedua (sebelah kanan) menunjukkan sebuah monosakarida heksosa (memiliki 6 atom C), ketosa (berstruktur keton/R-CO-R) sehingga dinamakan gula ketoheksosa.
Berdasarkan stereokimia, monosakarida terbagi menjadi beberapa golongan. Stereokimia adalah studi mengenai susunan spasial dari molekul. Salah satu bagian dari stereokimia adalah stereoisomer. Stereoisomer mengandung pengertian:
1. memiliki kesamaan order dan jenis ikatan
2. memiliki perbedaan susunan spasial
3. memiliki perbedaan properti (sifat).
Enantiomer merupakan pasangan dari stereoisomer. Dalam hal ini terdapat aturan yaitu:
1. Diberi awalan D dan L
2. Keduanya merupakan gambar cermin yang tak mungkin saling tumpang tindih
Gambar-gambar berikut memberikan penjelasan mengenai perbedaan susunan spasial dalam enatiomer.


Ilustrasi untuk enantiomer (perhatikan perbedaan susunan spasial yang ada)

Contoh enantiomer dari gula triosa (perhatikan perbedaan susunan spasial yang ada)
Monosakarida-monosakarida penting
Beberapa monosakarida penting bagi tubuh kita di antaranya adalah D-gliseraldehid, D-glukosa, D-fruktosa, D-galaktosa serta D-ribosa.
1. D-gliseraldehid (karbohidrat paling sederhana)
Karbohidrat ini hanya memiliki 3 atom C (triosa), berupa aldehid (aldosa) sehingga dinamakan aldotriosa.

D-gliseraldehid (perhatikan bahwa gula ini hanya memiliki 3 atom C sehingga disebut paling sederhana)
2. D-glukosa (karbohidrat terpenting dalam diet)
Glukosa merupakan aldoheksosa, yang sering kita sebut sebagai dekstrosa, gula anggur ataupun gula darah. Gula ini terbanyak ditemukan di alam.

D-glukosa (perhatikan bahwa glukosa mengalami siklisasi membentuk struktur cincin)
3. D-fruktosa (termanis dari semua gula)
Gula ini berbeda dengan gula yang lain karena merupakan ketoheksosa.

D-fruktosa (perhatikan bahwa fruktosa mengalami siklisasi membentuk struktur cincin)
4. D-galaktosa (bagian dari susu)
Gula ini tidak ditemukan tersendiri pada sistem biologis, namun merupakan bagian dari disakarida laktosa.

D-galaktosa (perhatikan bahwa galaktosa mengalami siklisasi membentuk struktur cincin)

Perbedaan pokok antara D-glukosa dan D-galaktosa (perhatikan daerah berarsis lingkaran)
5. D-ribosa (digunakan dalam pembentukan RNA)
Karena merupakan penyusun kerangka RNA maka ribosa penting artinya bagi genetika bukan merupakan sumber energi. Jika atom C nomor 2 dari ribosa kehilangan atom O, maka akan menjadi deoksiribosa yang merupakan penyusuna kerangka DNA.

D-ribosa (perhatikan gula ini memiliki 5 atom C)
Disakarida-disakarida penting
Beberapa disakarida penting bagi tubuh kita di antaranya adalah β-maltosa, β-laktosa serta sukrosa.
1. β-maltosa
Disakarida ini tak ditemukan di alam kecuali pada kecambah padi-padian. Maltosa merupakan gabungan dari 2 molekul glukosa.

β-maltosa (ikatan antara kedua monosakarida merupakan ikatan C1-4. Atom C nomor 1 yang tak berikatan dengan glukosa lain dalam posisi beta)
2. β-laktosa
Laktosa sering disebut sebagai gula susu. Disakarida ini tersusun atas glukosa dan galaktosa. Kita tidak dapat menggunakan galaktosa secara langsung, tetapi harus diubah menjadi glukosa.

β-laktosa (ikatan antara kedua monosakarida merupakan ikatan C1-4)
3. Sukrosa
Sukrosa merupakan gula terbanyak yang bisa didapatkan dari tumbuhan. Tumbuhan yang banyak dimanfaatkan karena kandungan sukrosa adalah tebu dan bit.

Sukrosa (berbeda dengan maltosa dan laktosa, ikatan yang menghubungkan kedua monosakarida adalah ikatan C1-2)
Polisakarida-polisakarida penting
Beberapa polisakarida penting bagi tubuh kita di antaranya adalah amilum (pati), glikogen dan selulosa.
1. Amilum
Pati merupakan polisakarida yang berfungsi sebagai cadangan energi bagi tumbuhan. Pati merupakan polimer α-D-glukosa dengan ikatan α (1-4). Kandungan glukosa pada pati bisa mencapai 4000 unit. Ada 2 macam amilum yaitu amilosa (pati berpolimer lurus) dan amilopektin (pati berpolimer bercabang-cabang). Sebagian besar pati merupakan amilopektin.


Struktur amilosa (perhatikan bahwa amilosa tidak bercabang)

Struktur amilopektin (bandingkan dengan amilosa)
2. Glikogen
Glikogen merupakan polimer glukosa dengan ikatan α (1-6). Polisakarida ini merupakan cadangan energi pada hewan dan manusia yang disimpan di hati dan otot sebagai granula. Glikogen serupa dengan amilopektin.

Struktur glikogen (bandingkan dengan amilum)
3. Selulosa
Selulosa tersusun atas rantai glukosa dengan ikatan β (1-4). Selulosa lazim disebut sebagai serat dan merupakan polisakarida terbanyak.

Struktur selulosa yang merupakan polimer dari glukosa (bandingkan dengan pati)
Karbohidrat-karbohidrat lain
Beberapa karbohidrat bergabung dengan komponen lain. Sebagai contoh adalah mukopolisakarida, suatu materi tipis, kental, menyerupai jelly dan melapisi sel.

Stuktur dari mukopolisakarida
Contoh yang lain adalah glikoprotein, suatu protein yang mengikat unit karbohidrat dengan ikatan kovalen. Struktur ini memainkan beberapa peran penting di antaranya dalam proses proteksi imunologis, pembekuan darah, pengenalan sel-sel, serta interaksi dengan bahan kimia lain.

Glikoprotein
Metabolisme karbohidrat
Pada bagian-bagian terdahulu Anda telah mempelajari berbagai macam karbohidrat, antara lain monosakarida, disakarida, oligosakarida serta polisakarida. Karbohidrat siap dikatabolisir menjadi energi jika berbentuk monosakarida. Energi yang dihasilkan berupa Adenosin trifosfat (ATP).
Glukosa merupakan karbohidrat terpenting. Dalam bentuk glukosalah massa karbohidrat makanan diserap ke dalam aliran darah, atau ke dalam bentuk glukosalah karbohidrat dikonversi di dalam hati, serta dari glukosalah semua bentuk karbohidrat lain dalam tubuh dapat dibentuk. Glukosa merupakan bahan bakar metabolik utama bagi jaringan mamalia (kecuali hewan pemamah biak) dan bahan bakar universal bagi janin. Unsur ini diubah menjadi karbohidrat lain dengan fungsi sangat spesifik, misalnya glikogen untuk simpanan, ribose dalam bentuk asam nukleat, galaktosa dalam laktosa susu, dalam senyawa lipid kompleks tertentu dan dalam bentuk gabungan dengan protein, yaitu glikoprotein serta proteoglikan.
Sekilas tentang metabolisme
Peristiwa yang dialami unsur-unsur makanan setelah dicerna dan diserap adalah METABOLISME INTERMEDIAT. Jadi metabolisme intermediat mencakup suatu bidang luas yang berupaya memahami bukan saja lintasan metabolik yang dialami oleh masing-masing molekul, tetapi juga interelasi dan mekanisme yang mengatur arus metabolit melewati lintasan tersebut.
Lintasan metabolisme dapat digolongkan menjadi 3 kategori:
1. Lintasan anabolik (penyatuan/pembentukan)
Ini merupakan lintasan yang digunakan pada sintesis senyawa pembentuk struktur dan mesin tubuh. Salah satu contoh dari kategori ini adalah sintesis protein.
2. Lintasan katabolik (pemecahan)
Lintasan ini meliputi berbagai proses oksidasi yang melepaskan energi bebas, biasanya dalam bentuk fosfat energi tinggi atau unsur ekuivalen pereduksi, seperti rantai respirasi dan fosforilasi oksidatif.
3. Lintasan amfibolik (persimpangan)
Lintasan ini memiliki lebih dari satu fungsi dan terdapat pada persimpangan metabolisme sehingga bekerja sebagai penghubung antara lintasan anabolik dan lintasan katabolik. Contoh dari lintasan ini adalah siklus asam sitrat.

Siklus asam sitrat sebagai lintasan amfibolik dalam metabolisme (perhatikan jalur persimpangan jalur katabolisme dan anabolisme) (dipetik dari: Murray dkk. Biokimia Harper)
Sifat diet atau makanan menentukan pola dasar metabolisme di dalam tubuh. Mamalia, termasuk manusia harus memproses hasil penyerapan produk-produk pencernaan karbohidrat, lipid dan protein dari makanan. Secara berurutan, produk-produk ini terutama adalah glukosa, asam lemak serta gliserol dan asam amino. Semua produk hasil pencernaan diproses melalui lintasan metaboliknya masing-masing menjadi suatu produk umum yaitu Asetil KoA, yang kemudian akan dioksidasi secara sempurna melalui siklus asam sitrat.

Ilustrasi skematis dari lintasan metabolik dasar
Terdapat beberapa jalur metabolisme karbohidrat baik yang tergolong sebagai katabolisme maupun anabolisme, yaitu glikolisis, oksidasi piruvat, siklus asam sitrat, glikogenesis, glikogenolisis serta glukoneogenesis.
Secara ringkas, jalur-jalur metabolisme karbohidrat dijelaskan sebagai berikut:
1. Glukosa sebagai bahan bakar utama akan mengalami glikolisis (dipecah) menjadi 2 piruvat jika tersedia oksigen. Dalam tahap ini dihasilkan energi berupa ATP.
2. Selanjutnya masing-masing piruvat dioksidasi menjadi asetil KoA. Dalam tahap ini dihasilkan energi berupa ATP.
3. Asetil KoA akan masuk ke jalur persimpangan yaitu siklus asam sitrat. Dalam tahap ini dihasilkan energi berupa ATP.
4. Jika sumber glukosa berlebihan, melebihi kebutuhan energi kita maka glukosa tidak dipecah, melainkan akan dirangkai menjadi polimer glukosa (disebut glikogen). Glikogen ini disimpan di hati dan otot sebagai cadangan energi jangka pendek. Jika kapasitas penyimpanan glikogen sudah penuh, maka karbohidrat harus dikonversi menjadi jaringan lipid sebagai cadangan energi jangka panjang.
5. Jika terjadi kekurangan glukosa dari diet sebagai sumber energi, maka glikogen dipecah menjadi glukosa. Selanjutnya glukosa mengalami glikolisis, diikuti dengan oksidasi piruvat sampai dengan siklus asam sitrat.
6. Jika glukosa dari diet tak tersedia dan cadangan glikogenpun juga habis, maka sumber energi non karbohidrat yaitu lipid dan protein harus digunakan. Jalur ini dinamakan glukoneogenesis (pembentukan glukosa baru) karena dianggap lipid dan protein harus diubah menjadi glukosa baru yang selanjutnya mengalami katabolisme untuk memperoleh energi.

Beberapa jalur metabolisme karbohidrat
Glikolisis
Glikolisis berlangsung di dalam sitosol semua sel. Lintasan katabolisme ini adalah proses pemecahan glukosa menjadi:
1. asam piruvat, pada suasana aerob (tersedia oksigen)
2. asam laktat, pada suasana anaerob (tidak tersedia oksigen)
Glikolisis merupakan jalur utama metabolisme glukosa agar terbentuk asam piruvat, dan selanjutnya asetil-KoA untuk dioksidasi dalam siklus asam sitrat (Siklus Kreb’s). Selain itu glikolisis juga menjadi lintasan utama metabolisme fruktosa dan galaktosa.
Keseluruhan persamaan reaksi untuk glikolisis yang menghasilkan laktat adalah:
Glukosa + 2ADP +2Pi à 2L(+)-Laktat +2ATP +2H2O
 Secara rinci, tahap-tahap dalam lintasan glikolisis adalah sebagai berikut (pada setiap tahap, lihat dan hubungkan dengan Gambar Lintasan detail metabolisme karbohidrat):
Secara rinci, tahap-tahap dalam lintasan glikolisis adalah sebagai berikut (pada setiap tahap, lihat dan hubungkan dengan Gambar Lintasan detail metabolisme karbohidrat):
1. Glukosa masuk lintasan glikolisis melalui fosforilasi menjadi glukosa-6 fosfat dengan dikatalisir oleh enzim heksokinase atau glukokinase pada sel parenkim hati dan sel Pulau Langerhans pancreas. Proses ini memerlukan ATP sebagai donor fosfat. ATP bereaksi sebagai kompleks Mg-ATP. Terminal fosfat berenergi tinggi pada ATP digunakan, sehingga hasilnya adalah ADP. (-1P)
Reaksi ini disertai kehilangan energi bebas dalam jumlah besar berupa kalor, sehingga dalam kondisi fisiologis dianggap irrevesibel. Heksokinase dihambat secara alosterik oleh produk reaksi glukosa 6-fosfat.
Mg2+
Glukosa + ATP à glukosa 6-fosfat + ADP
2. Glukosa 6-fosfat diubah menjadi Fruktosa 6-fosfat dengan bantuan enzim fosfoheksosa isomerase dalam suatu reaksi isomerasi aldosa-ketosa. Enzim ini hanya bekerja pada anomer µ-glukosa 6-fosfat.
µ-D-glukosa 6-fosfat « µ-D-fruktosa 6-fosfat
3. Fruktosa 6-fosfat diubah menjadi Fruktosa 1,6-bifosfat dengan bantuan enzim fosfofruktokinase. Fosfofruktokinase merupakan enzim yang bersifat alosterik sekaligus bisa diinduksi, sehingga berperan penting dalam laju glikolisis. Dalam kondisi fisiologis tahap ini bisa dianggap irreversible. Reaksi ini memerlukan ATP sebagai donor fosfat, sehingga hasilnya adalah ADP.(-1P)
µ-D-fruktosa 6-fosfat + ATP « D-fruktosa 1,6-bifosfat
4. Fruktosa 1,6-bifosfat dipecah menjadi 2 senyawa triosa fosfat yaitu gliserahdehid 3-fosfat dan dihidroksi aseton fosfat. Reaksi ini dikatalisir oleh enzim aldolase (fruktosa 1,6-bifosfat aldolase).
D-fruktosa 1,6-bifosfat« D-gliseraldehid 3-fosfat + dihidroksiaseton fosfat
5. Gliseraldehid 3-fosfat dapat berubah menjadi dihidroksi aseton fosfat dan sebaliknya (reaksi interkonversi). Reaksi bolak-balik ini mendapatkan katalisator enzim fosfotriosa isomerase.
D-gliseraldehid 3-fosfat « dihidroksiaseton fosfat
6. Glikolisis berlangsung melalui oksidasi Gliseraldehid 3-fosfat menjadi 1,3-bifosfogliserat, dan karena aktivitas enzim fosfotriosa isomerase, senyawa dihidroksi aseton fosfat juga dioksidasi menjadi 1,3-bifosfogliserat melewati gliseraldehid 3-fosfat.
D-gliseraldehid 3-fosfat + NAD+ + Pi« 1,3-bifosfogliserat + NADH + H+
Enzim yang bertanggung jawab terhadap oksidasi di atas adalah gliseraldehid 3-fosfat dehidrogenase, suatu enzim yang bergantung kepada NAD.
Atom-atom hydrogen yang dikeluarkan dari proses oksidasi ini dipindahkan kepada NAD+ yang terikat pada enzim. Pada rantai respirasi mitokondria akan dihasilkan tiga fosfat berenergi tinggi. (+3P)
Catatan:
Karena fruktosa 1,6-bifosfat yang memiliki 6 atom C dipecah menjadi Gliseraldehid 3-fosfat dan dihidroksi aseton fosfat yang masing-masing memiliki 3 atom C, dengan demikian terbentuk 2 molekul gula yang masing-masing beratom C tiga (triosa). Jika molekul dihidroksiaseton fosfat juga berubah menjadi 1,3-bifosfogliserat, maka dari 1 molekul glukosa pada bagian awal, sampai dengan tahap ini akan menghasilkan 2 x 3P = 6P. (+6P)
7. Energi yang dihasilkan dalam proses oksidasi disimpan melalui pembentukan ikatan sulfur berenergi tinggi, setelah fosforolisis, sebuah gugus fosfat berenergi tinggi dalam posisi 1 senyawa 1,3 bifosfogliserat. Fosfat berenergi tinggi ini ditangkap menjadi ATP dalam reaksi lebih lanjut dengan ADP, yang dikatalisir oleh enzim fosfogliserat kinase. Senyawa sisa yang dihasilkan adalah 3-fosfogliserat.
1,3-bifosfogliserat + ADP « 3-fosfogliserat + ATP
Catatan:
Karena ada dua molekul 1,3-bifosfogliserat, maka energi yang dihasilkan adalah 2 x 1P = 2P. (+2P)
8. 3-fosfogliserat diubah menjadi 2-fosfogliserat dengan dikatalisir oleh enzim fosfogliserat mutase. Senyawa 2,3-bifosfogliserat (difosfogliserat, DPG) merupakan intermediate dalam reaksi ini.
3-fosfogliserat « 2-fosfogliserat
9. 2-fosfogliserat diubah menjadi fosfoenol piruvat (PEP) dengan bantuan enzim enolase. Reaksi ini melibatkan dehidrasi serta pendistribusian kembali energi di dalam molekul, menaikkan valensi fosfat dari posisi 2 ke status berenergi tinggi.
Enolase dihambat oleh fluoride, suatu unsure yang dapat digunakan jika glikolisis di dalam darah perlu dicegah sebelum kadar glukosa darah diperiksa. Enzim ini bergantung pada keberadaan Mg2+ atau Mn2+.
2-fosfogliserat « fosfoenol piruvat + H2O
10. Fosfat berenergi tinggi PEP dipindahkan pada ADP oleh enzim piruvat kinase sehingga menghasilkan ATP. Enol piruvat yang terbentuk dalam reaksi ini mengalami konversi spontan menjadi keto piruvat. Reaksi ini disertai kehilangan energi bebas dalam jumlah besar sebagai panas dan secara fisiologis adalah irreversible.
Fosfoenol piruvat + ADP à piruvat + ATP
Catatan:
Karena ada 2 molekul PEP maka terbentuk 2 molekul enol piruvat sehingga total hasil energi pada tahap ini adalah 2 x 1P = 2P. (+2P)
11. Jika keadaan bersifat anaerob (tak tersedia oksigen), reoksidasi NADH melalui pemindahan sejumlah unsure ekuivalen pereduksi akan dicegah. Piruvat akan direduksi oleh NADH menjadi laktat. Reaksi ini dikatalisir oleh enzim laktat dehidrogenase.
Piruvat + NADH + H+ à L(+)-Laktat + NAD+
Dalam keadaan aerob, piruvat diambil oleh mitokondria, dan setelah konversi menjadi asetil-KoA, akan dioksidasi menjadi CO2 melalui siklus asam sitrat (Siklus Kreb’s). Ekuivalen pereduksi dari reaksi NADH + H+ yang terbentuk dalam glikolisis akan diambil oleh mitokondria untuk oksidasi melalui salah satu dari reaksi ulang alik (shuttle).
Kesimpulan:
Pada glikolisis aerob, energi yang dihasilkan terinci sebagai berikut:
– hasil tingkat substrat :+ 4P
– hasil oksidasi respirasi :+ 6P
– jumlah :+10P
– dikurangi untuk aktifasi glukosa dan fruktosa 6P : – 2P
+ 8P
Pada glikolisis anaerob, energi yang dihasilkan terinci sebagai berikut:
– hasil tingkat substrat :+ 4P
– hasil oksidasi respirasi :+ 0P
– jumlah :+ 4P
– dikurangi untuk aktifasi glukosa dan fruktosa 6P : – 2P
+ 2P
Oksidasi piruvat
Dalam jalur ini, piruvat dioksidasi (dekarboksilasi oksidatif) menjadi Asetil-KoA, yang terjadi di dalam mitokondria sel. Reaksi ini dikatalisir oleh berbagai enzim yang berbeda yang bekerja secara berurutan di dalam suatu kompleks multienzim yang berkaitan dengan membran interna mitokondria. Secara kolektif, enzim tersebut diberi nama kompleks piruvat dehidrogenase dan analog dengan kompleks µ-keto glutarat dehidrogenase pada siklus asam sitrat.
Jalur ini merupakan penghubung antara glikolisis dengan siklus Kreb’s. Jalur ini juga merupakan konversi glukosa menjadi asam lemak dan lemak dan sebaliknya dari senyawa non karbohidrat menjadi karbohidrat.
Rangkaian reaksi kimia yang terjadi dalam lintasan oksidasi piruvat adalah sebagai berikut:
1. Dengan adanya TDP (thiamine diphosphate), piruvat didekarboksilasi menjadi derivate hidroksietil tiamin difosfat terikat enzim oleh komponen kompleks enzim piruvat dehidrogenase. Produk sisa yang dihasilkan adalah CO2.
2. Hidroksietil tiamin difosfat akan bertemu dengan lipoamid teroksidasi, suatu kelompok prostetik dihidroksilipoil transasetilase untuk membentuk asetil lipoamid, selanjutnya TDP lepas.
3. Selanjutnya dengan adanya KoA-SH, asetil lipoamid akan diubah menjadi asetil KoA, dengan hasil sampingan berupa lipoamid tereduksi.
4. Siklus ini selesai jika lipoamid tereduksi direoksidasi oleh flavoprotein, yang mengandung FAD, pada kehadiran dihidrolipoil dehidrogenase. Akhirnya flavoprotein tereduksi ini dioksidasi oleh NAD+, yang akhirnya memindahkan ekuivalen pereduksi kepada rantai respirasi.
Piruvat + NAD+ + KoA à Asetil KoA + NADH + H+ + CO2

Siklus asam sitrat
Siklus ini juga sering disebut sebagai siklus Kreb’s dan siklus asam trikarboksilat dan berlangsung di dalam mitokondria. Siklus asam sitrat merupakan jalur bersama oksidasi karbohidrat, lipid dan protein.
Siklus asam sitrat merupakan rangkaian reaksi yang menyebabkan katabolisme asetil KoA, dengan membebaskan sejumlah ekuivalen hidrogen yang pada oksidasi menyebabkan pelepasan dan penangkapan sebagaian besar energi yang tersedia dari bahan baker jaringan, dalam bentuk ATP. Residu asetil ini berada dalam bentuk asetil-KoA (CH3-CO~KoA, asetat aktif), suatu ester koenzim A. Ko-A mengandung vitamin asam pantotenat.
Fungsi utama siklus asam sitrat adalah sebagai lintasan akhir bersama untuk oksidasi karbohidrat, lipid dan protein. Hal ini terjadi karena glukosa, asam lemak dan banyak asam amino dimetabolisir menjadi asetil KoA atau intermediat yang ada dalam siklus tersebut.

Siklus asam sitrat sebagai jalur bersama metabolisme karbohidrat, lipid dan protein
(dipetik dari: Murray dkk. Biokimia Harper)
Selama proses oksidasi asetil KoA di dalam siklus, akan terbentuk ekuivalen pereduksi dalam bentuk hidrogen atau elektron sebagai hasil kegiatan enzim dehidrogenase spesifik. Unsur ekuivalen pereduksi ini kemudian memasuki rantai respirasi tempat sejumlah besar ATP dihasilkan dalam proses fosforilasi oksidatif. Pada keadaan tanpa oksigen (anoksia) atau kekurangan oksigen (hipoksia) terjadi hambatan total pada siklus tersebut.
Enzim-enzim siklus asam sitrat terletak di dalam matriks mitokondria, baik dalam bentuk bebas ataupun melekat pada permukaan dalam membran interna mitokondria sehingga memfasilitasi pemindahan unsur ekuivalen pereduksi ke enzim terdekat pada rantai respirasi, yang bertempat di dalam membran interna mitokondria.

Lintasan detail Siklus Kreb’s (dipetik dari: Murray dkk. Biokimia Harper)
Reaksi-reaksi pada siklus asam sitrat diuraikan sebagai berikut:
1. Kondensasi awal asetil KoA dengan oksaloasetat membentuk sitrat, dikatalisir oleh enzim sitrat sintase menyebabkan sintesis ikatan karbon ke karbon di antara atom karbon metil pada asetil KoA dengan atom karbon karbonil pada oksaloasetat. Reaksi kondensasi, yang membentuk sitril KoA, diikuti oleh hidrolisis ikatan tioester KoA yang disertai dengan hilangnya energi bebas dalam bentuk panas dalam jumlah besar, memastikan reaksi tersebut selesai dengan sempurna.
Asetil KoA + Oksaloasetat + H2O à Sitrat + KoA
2. Sitrat dikonversi menjadi isositrat oleh enzim akonitase (akonitat hidratase) yang mengandung besi Fe2+ dalam bentuk protein besi-sulfur (Fe:S). Konversi ini berlangsung dalam 2 tahap, yaitu: dehidrasi menjadi sis-akonitat, yang sebagian di antaranya terikat pada enzim dan rehidrasi menjadi isositrat.

Reaksi tersebut dihambat oleh fluoroasetat yang dalam bentuk fluoroasetil KoA mengadakan kondensasi dengan oksaloasetat untuk membentuk fluorositrat. Senyawa terakhir ini menghambat akonitase sehingga menimbulkan penumpukan sitrat.
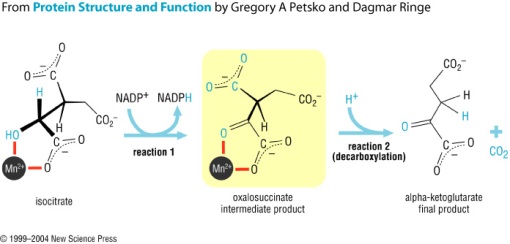
3. Isositrat mengalami dehidrogenasi membentuk oksalosuksinat dengan adanya enzim isositrat dehidrogenase. Di antara enzim ini ada yang spesifik NAD+, hanya ditemukan di dalam mitokondria. Dua enzim lainnya bersifat spesifik NADP+ dan masing-masing secara berurutan dijumpai di dalam mitokondria serta sitosol. Oksidasi terkait rantai respirasi terhadap isositrat berlangsung hampir sempurna melalui enzim yang bergantung NAD+.
Isositrat + NAD+ « Oksalosuksinat « µ–ketoglutarat + CO2 + NADH + H+
(terikat enzim)
Kemudian terjadi dekarboksilasi menjadi µ–ketoglutarat yang juga dikatalisir oleh enzim isositrat dehidrogenase. Mn2+ atau Mg2+ merupakan komponen penting reaksi dekarboksilasi. Oksalosuksinat tampaknya akan tetap terikat pada enzim sebagai intermediate dalam keseluruhan reaksi.
4. Selanjutnya µ–ketoglutarat mengalami dekarboksilasi oksidatif melalui cara yang sama dengan dekarboksilasi oksidatif piruvat, dengan kedua substrat berupa asam µ–keto.
µ–ketoglutarat + NAD+ + KoA à Suksinil KoA + CO2 + NADH + H+
Reaksi tersebut yang dikatalisir oleh kompleks µ–ketoglutarat dehidrogenase, juga memerlukan kofaktor yang idenstik dengan kompleks piruvat dehidrogenase, contohnya TDP, lipoat, NAD+, FAD serta KoA, dan menghasilkan pembentukan suksinil KoA (tioester berenergi tinggi). Arsenit menghambat reaksi di atas sehingga menyebabkan penumpukan µ–ketoglutarat.
5. Tahap selanjutnya terjadi perubahan suksinil KoA menjadi suksinat dengan adanya peran enzim suksinat tiokinase (suksinil KoA sintetase).
Suksinil KoA + Pi + ADP « Suksinat + ATP + KoA
Dalam siklus asam sitrat, reaksi ini adalah satu-satunya contoh pembentukan fosfat berenergi tinggi pada tingkatan substrat dan terjadi karena pelepasan energi bebas dari dekarboksilasi oksidatif µ–ketoglutarat cukup memadai untuk menghasilkan ikatan berenergi tinggi disamping pembentukan NADH (setara dengan 3~P.
6. Suksinat dimetabolisir lebih lanjut melalui reaksi dehidrogenasi yang diikuti oleh penambahan air dan kemudian oleh dehidrogenasi lebih lanjut yang menghasilkan kembali oksaloasetat.
Suksinat + FAD « Fumarat + FADH2
Reaksi dehidrogenasi pertama dikatalisir oleh enzim suksinat dehidrogenase yang terikat pada permukaan dalam membrane interna mitokondria, berbeda dengan enzim-enzim lain yang ditemukan pada matriks. Reaksi ini adalah satu-satunya reaksi dehidrogenasi dalam siklus asam sitrat yang melibatkan pemindahan langsung atom hydrogen dari substrat kepada flavoprotein tanpa peran NAD+. Enzim ini mengandung FAD dan protein besi-sulfur (Fe:S). Fumarat terbentuk sebagai hasil dehidrogenasi. Fumarase (fumarat hidratase) mengkatalisir penambahan air pada fumarat untuk menghasilkan malat.
Fumarat + H2O « L-malat
Enzim fumarase juga mengkatalisir penambahan unsure-unsur air kepada ikatan rangkap fumarat dalam konfigurasi trans.
Malat dikonversikan menjadi oksaloasetat dengan katalisator berupa enzim malat dehidrogenase, suatu reaksi yang memerlukan NAD+.
L-Malat + NAD+ « oksaloasetat + NADH + H+
Enzim-enzim dalam siklus asam sitrat, kecuali alfa ketoglutarat dan suksinat dehidrogenase juga ditemukan di luar mitokondria. Meskipun dapat mengkatalisir reaksi serupa, sebagian enzim tersebut, misalnya malat dehidrogenase pada kenyataannya mungkin bukan merupakan protein yang sama seperti enzim mitokondria yang mempunyai nama sama (dengan kata lain enzim tersebut merupakan isoenzim).
Energi yang dihasilkan dalam siklus asam sitrat
Pada proses oksidasi yang dikatalisir enzim dehidrogenase, 3 molekul NADH dan 1 FADH2 akan dihasilkan untuk setiap molekul asetil-KoA yang dikatabolisir dalam siklus asam sitrat. Dalam hal ini sejumlah ekuivalen pereduksi akan dipindahkan ke rantai respirasi dalam membrane interna mitokondria (lihat kembali gambar tentang siklus ini).
Selama melintasi rantai respirasi tersebut, ekuivalen pereduksi NADH menghasilkan 3 ikatan fosfat berenergi tinggi melalui esterifikasi ADP menjadi ATP dalam proses fosforilasi oksidatif. Namun demikian FADH2 hanya menghasilkan 2 ikatan fosfat berenergi tinggi. Fosfat berenergi tinggi selanjutnya akan dihasilkan pada tingkat siklus itu sendiri (pada tingkat substrat) pada saat suksinil KoA diubah menjadi suksinat.
Dengan demikian rincian energi yang dihasilkan dalam siklus asam sitrat adalah:
1. Tiga molekul NADH, menghasilkan : 3 X 3P = 9P
2. Satu molekul FADH2, menghasilkan : 1 x 2P = 2P
3. Pada tingkat substrat = 1P
Jumlah = 12P
Satu siklus Kreb’s akan menghasilkan energi 3P + 3P + 1P + 2P + 3P = 12P.
Kalau kita hubungkan jalur glikolisis, oksidasi piruvat dan siklus Kreb’s, akan dapat kita hitung bahwa 1 mol glukosa jika dibakar sempurna (aerob) akan menghasilkan energi dengan rincian sebagai berikut:
1. Glikolisis : 8P
2. Oksidasi piruvat (2 x 3P) : 6P
3. Siklus Kreb’s (2 x 12P) : 24P
Jumlah : 38P
Glikogenesis
Tahap pertama metabolisme karbohidrat adalah pemecahan glukosa (glikolisis) menjadi piruvat. Selanjutnya piruvat dioksidasi menjadi asetil KoA. Akhirnya asetil KoA masuk ke dalam rangkaian siklus asam sitrat untuk dikatabolisir menjadi energi.
Proses di atas terjadi jika kita membutuhkan energi untuk aktifitas, misalnya berpikir, mencerna makanan, bekerja dan sebagainya. Jika kita memiliki glukosa melampaui kebutuhan energi, maka kelebihan glukosa yang ada akan disimpan dalam bentuk glikogen. Proses anabolisme ini dinamakan glikogenesis.
Glikogen merupakan bentuk simpanan karbohidrat yang utama di dalam tubuh dan analog dengan amilum pada tumbuhan. Unsur ini terutama terdapat didalam hati (sampai 6%), otot jarang melampaui jumlah 1%. Akan tetapi karena massa otot jauh lebih besar daripada hati, maka besarnya simpanan glikogen di otot bisa mencapai tiga sampai empat kali lebih banyak. Seperti amilum, glikogen merupakan polimer µ-D-Glukosa yang bercabang.
Glikogen otot berfungsi sebagai sumber heksosa yang tersedia dengan mudah untuk proses glikolisis di dalam otot itu sendiri. Sedangkan glikogen hati sangat berhubungan dengan simpanan dan pengiriman heksosa keluar untuk mempertahankan kadar glukosa darah, khususnya pada saat di antara waktu makan. Setelah 12-18 jam puasa, hampir semua simpanan glikogen hati terkuras habis. Tetapi glikogen otot hanya terkuras secara bermakna setelah seseorang melakukan olahraga yang berat dan lama.
Rangkaian proses terjadinya glikogenesis digambarkan sebagai berikut:
1. Glukosa mengalami fosforilasi menjadi glukosa 6-fosfat (reaksi yang lazim terjadi juga pada lintasan glikolisis). Di otot reaksi ini dikatalisir oleh heksokinase sedangkan di hati oleh glukokinase.
2. Glukosa 6-fosfat diubah menjadi glukosa 1-fosfat dalam reaksi dengan bantuan katalisator enzim fosfoglukomutase. Enzim itu sendiri akan mengalami fosforilasi dan gugus fosfo akan mengambil bagian di dalam reaksi reversible yang intermediatnya adalah glukosa 1,6-bifosfat.
Enz-P + Glukosa 6-fosfat «Enz + Glukosa 1,6-bifosfat « Enz-P + Glukosa 1-fosfat
3. Selanjutnya glukosa 1-fosfat bereaksi dengan uridin trifosfat (UTP) untuk membentuk uridin difosfat glukosa (UDPGlc). Reaksi ini dikatalisir oleh enzim UDPGlc pirofosforilase.
UTP + Glukosa 1-fosfat « UDPGlc + PPi

Uridin difosfat glukosa (UDPGlc) (dipetik dari: Murray dkk. Biokimia Harper)

4. Hidrolisis pirofosfat inorganic berikutnya oleh enzim pirofosfatase inorganik akan menarik reaksi kea rah kanan persamaan reaksi
5. Atom C1 pada glukosa yang diaktifkan oleh UDPGlc membentuk ikatan glikosidik dengan atom C4 pada residu glukosa terminal glikogen, sehingga membebaskan uridin difosfat. Reaksi ini dikatalisir oleh enzim glikogen sintase. Molekul glikogen yang sudah ada sebelumnya (disebut glikogen primer) harus ada untuk memulai reaksi ini. Glikogen primer selanjutnya dapat terbentuk pada primer protein yang dikenal sebagai glikogenin.
UDPGlc + (C6)n à UDP + (C6)n+1
Glikogen Glikogen
Residu glukosa yang lebih lanjut melekat pada posisi 1à4 untuk membentuk rantai pendek yang diaktifkan oleh glikogen sintase. Pada otot rangka glikogenin tetap melekat pada pusat molekul glikogen, sedangkan di hati terdapat jumlah molekul glikogen yang melebihi jumlah molekul glikogenin.
6. Setelah rantai dari glikogen primer diperpanjang dengan penambahan glukosa tersebut hingga mencapai minimal 11 residu glukosa, maka enzim pembentuk cabang memindahkan bagian dari rantai 1à4 (panjang minimal 6 residu glukosa) pada rantai yang berdekatan untuk membentuk rangkaian 1à6 sehingga membuat titik cabang pada molekul tersebut. Cabang-cabang ini akan tumbuh dengan penambahan lebih lanjut 1àglukosil dan pembentukan cabang selanjutnya. Setelah jumlah residu terminal yang non reduktif bertambah, jumlah total tapak reaktif dalam molekul akan meningkat sehingga akan mempercepat glikogenesis maupun glikogenolisis.
Tahap-tahap perangkaian glukosa demi glukosa digambarkan pada bagan berikut.

Biosintesis glikogen (dipetik dari: Murray dkk. Biokimia Harper)
Tampak bahwa setiap penambahan 1 glukosa pada glikogen dikatalisir oleh enzim glikogen sintase. Sekelompok glukosa dalam rangkaian linier dapat putus dari glikogen induknya dan berpindah tempat untuk membentuk cabang. Enzim yang berperan dalam tahap ini adalah enzim pembentuk cabang (branching enzyme).
Glikogenolisis
Jika glukosa dari diet tidak dapat mencukupi kebutuhan, maka glikogen harus dipecah untuk mendapatkan glukosa sebagai sumber energi. Proses ini dinamakan glikogenolisis. Glikogenolisis seakan-akan kebalikan dari glikogenesis, akan tetapi sebenarnya tidak demikian. Untuk memutuskan ikatan glukosa satu demi satu dari glikogen diperlukan enzim fosforilase. Enzim ini spesifik untuk proses fosforolisis rangkaian 1à4 glikogen untuk menghasilkan glukosa 1-fosfat. Residu glukosil terminal pada rantai paling luar molekul glikogen dibuang secara berurutan sampai kurang lebih ada 4 buah residu glukosa yang tersisa pada tiap sisi cabang 1à6.
(C6)n + Pi à (C6)n-1 + Glukosa 1-fosfat
Glikogen Glikogen
Glukan transferase dibutuhkan sebagai katalisator pemindahan unit trisakarida dari satu cabang ke cabang lainnya sehingga membuat titik cabang 1à6 terpajan. Hidrolisis ikatan 1à6 memerlukan kerja enzim enzim pemutus cabang (debranching enzyme) yang spesifik. Dengan pemutusan cabang tersebut, maka kerja enzim fosforilase selanjutnya dapat berlangsung.

Tahap-tahap glikogenolisis (dipetik dari: Murray dkk. Biokimia Harper)
Glukoneogenesis
Glukoneogenesis terjadi jika sumber energi dari karbohidrat tidak tersedia lagi. Maka tubuh adalah menggunakan lemak sebagai sumber energi. Jika lemak juga tak tersedia, barulah memecah protein untuk energi yang sesungguhnya protein berperan pokok sebagai pembangun tubuh.
Jadi bisa disimpulkan bahwa glukoneogenesis adalah proses pembentukan glukosa dari senyawa-senyawa non karbohidrat, bisa dari lipid maupun protein.
Secara ringkas, jalur glukoneogenesis dari bahan lipid maupun protein dijelaskan sebagai berikut:
1. Lipid terpecah menjadi komponen penyusunnya yaitu asam lemak dan gliserol. Asam lemak dapat dioksidasi menjadi asetil KoA. Selanjutnya asetil KoA masuk dalam siklus Kreb’s. Sementara itu gliserol masuk dalam jalur glikolisis.
2. Untuk protein, asam-asam amino penyusunnya akan masuk ke dalam siklus Kreb’s.

Ringkasan jalur glukoneogenesis (dipetik dari: Murray dkk. Biokimia Harper)

Lintasan metabolisme karbohidrat, lipid dan protein. Perhatikan jalur glukoneogenesis yaitu masuknya lipid dan asam amino ke dalam lintasan (dipetik dari: Murray dkk. Biokimia Harper)

Glukoneogenesis dari bahan protein. Dalam hal ini protein telah dipecah menjadi berbagai macam asam amino (dipetik dari: Murray dkk. Biokimia Harper)

























 Secara rinci, tahap-tahap dalam lintasan glikolisis adalah sebagai berikut (pada setiap tahap, lihat dan hubungkan dengan Gambar Lintasan detail metabolisme karbohidrat):
Secara rinci, tahap-tahap dalam lintasan glikolisis adalah sebagai berikut (pada setiap tahap, lihat dan hubungkan dengan Gambar Lintasan detail metabolisme karbohidrat):










Komentar Terbaru